在癌症研究中,代谢重编程一直是科学家们关注的焦点。大多数肿瘤细胞主要依赖糖酵解途径产能,以确保细胞存活并促进其增殖。然而,近些年越来越多的证据表明,代谢酶不仅参与代谢途径,还可能具有“兼职”功能(moonlighting function),可参与细胞周期调控、DNA损伤修复、细胞增殖、肿瘤微环境调节等,从而影响癌症的发生和发展。
RNA结合蛋白(RBP)通常被认为是细胞中一类重要的蛋白,通过特殊的RNA结合域(RNA-binding domain, RBD)与RNA上的特定基序(motif)或RNA二级结构相结合,广泛参与到RNA的剪切、转运、序列编辑、胞内定位及翻译控制等多个转录后调控过程。4-羟苯丙酮酸双加氧酶(HPD)是酪氨酸分解代谢途径中的第二个关键酶,其催化4-羟苯丙酮酸(4-Hydroxyphenylpyruvic acid, 4-HPPA)转变成尿黑酸(homogentisic acid, HGA)。团队前期研究发现HPD在肺癌中高表达,其通过激活AMPK-HDAC10-G6PD轴调控磷酸戊糖途径而促进肺癌生长(Cell Death Dis. 2019;10(7):525)。但是,HPD在卵巢癌中的作用机制还远未阐述清楚,尤其是HPD作为RNA结合蛋白调控卵巢癌细胞代谢的作用及分子机制未见报道。
2025年6月10日,Advanced Science杂志在线发表了南开大学山长亮课题组与天津中医药大学张帅课题组题为“HPD is an RNA-Binding Protein Sustaining Ovarian Cancer Cell Glycolysis, Tumor Growth, and Drug Resistance”的研究性论文。该研究揭示HPD作为一种新型RBP,通过调控mRNA翻译促进卵巢癌糖代谢和肿瘤生长。

该研究发现,HPD通过其RNA结合结构域(RBD)直接结合mRNA的CDS区域,显著提升这些mRNA的翻译效率,特别是糖酵解代谢酶TPI和ENO1的mRNA的翻译,从而促进卵巢癌糖酵解途径并驱动肿瘤发展。更重要的是,阻断HPD的RBD功能域可破坏其结合RNA的生物学功能,进而抑制全局mRNA翻译并阻碍癌症发展。同时,研究还发现阻断HPD与mRNA的结合,还会增强化疗药物紫杉醇的疗效。
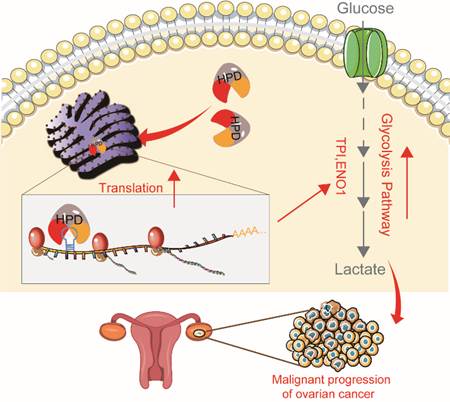
这项研究不仅刷新了酪氨酸代谢酶HPD的经典理论框架,还为卵巢癌的精准治疗提供了新思路。未来,特异性靶向HPD-RBP功能域的小分子抑制剂有望成为下一代抗癌药物研发的重要突破口,为临床治疗提供更精准的“分子手术刀”。
南开大学为该项工作的第一完成单位,南开大学药学院2020级博士生谢飞(目前就职空军军医大学药学院)和在读博士生张韩、戴昕彤、涂梦欣为该论文的共同第一作者。南开大学山长亮教授和天津中医药大学张帅研究员为本文的通讯作者。该研究得到天津市中心妇产科医院妇瘤科赵建国主任医师、天津医科大学肿瘤医院放射治疗科陈忠杰主任医师和南开大学第一附属医院张春泽主任医师的大力支持与帮助。该工作得到国家自然科学基金委项目和天津市自然科学基金的资助。