南开大学药学院赵炜老师课题组在国际知名学术期刊《Acta Biomaterialia》发表题为“An efficient and safe MUC1-dendritic cell-derived exosome conjugate vaccine elicits potent cellular and humoral immunity and tumor inhibition in vivo”的研究论文。研究主要提出,利用DCs来源外泌体优秀的纳米级载药尺寸及其所含丰富的免疫刺激分子,作为MUC1(Tn)肿瘤相关糖抗原的运载工具及免疫佐剂,制备出一种新型有效的抗肿瘤疫苗用于相关癌症的治疗及预防。

近年来,以“强化和提高”免疫激活机制为前提的抗肿瘤免疫疗法的提出,为抗肿瘤治疗开辟了新的思路,被誉为癌症治疗的第三次革命。癌症疫苗作为抗肿瘤免疫疗法的一个重要分支,已在抗肿瘤临床上起到了较好的治疗效果。然而临床上癌症患者通常表现出较强的免疫抑制状态,所以增加以抗肿瘤抗原为基础的癌症疫苗的免疫原性,帮助患者规避这种免疫无能效应,诱导机体对该抗原产生较强的免疫识别及反应是目前癌症疫苗开发的关键难题之一。
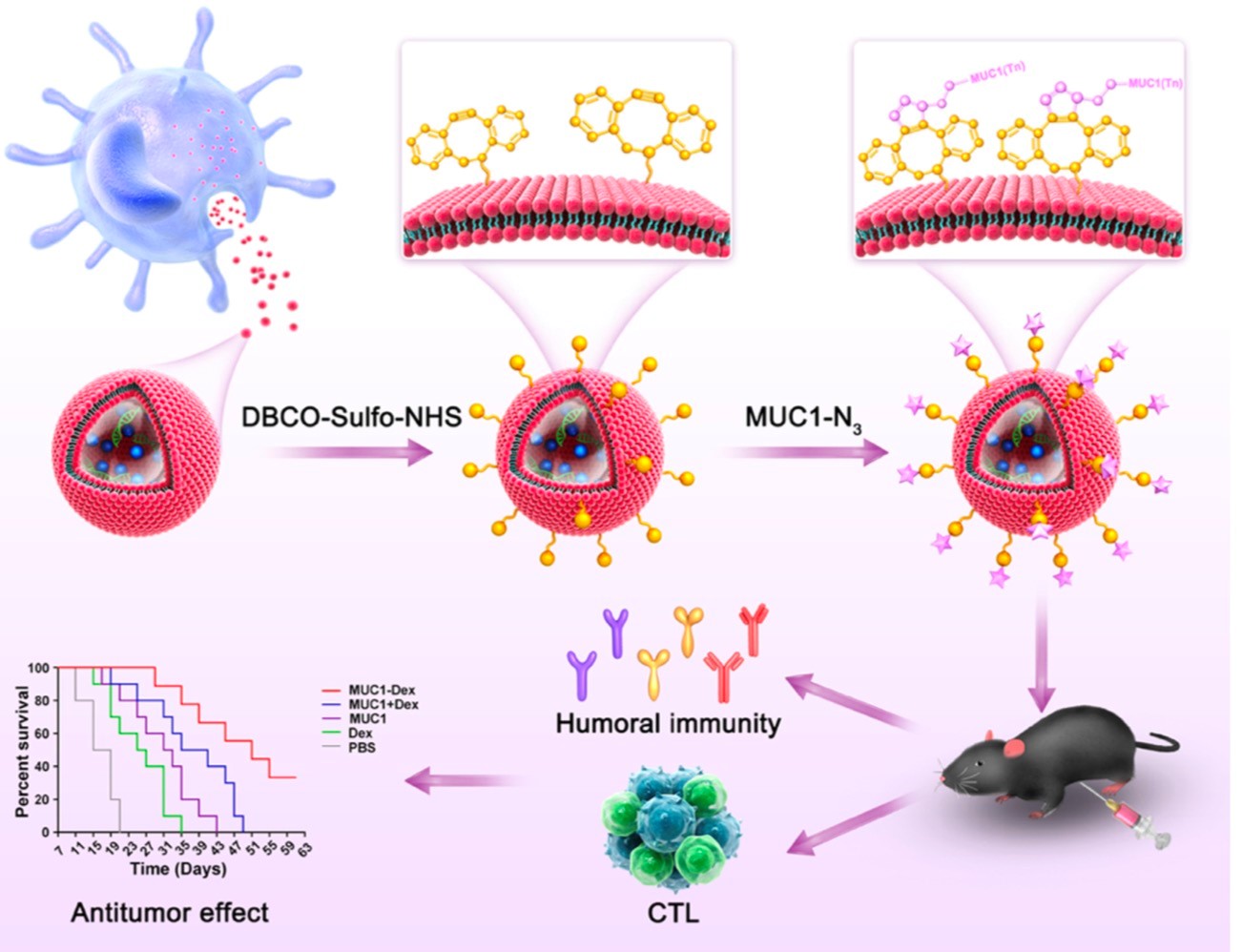
外泌体是一种可由多种类型细胞所分泌的直径大约在30-150 nm的细胞外囊泡,在细胞间通讯中起着重要作用。由于其较小的纳米级尺寸,目前已在活性药物递送系统广泛应用。尤其是DCs来源的外泌体因其自身就携带有与母体DCs相同的多种抗原呈递分子,所有,相比于其他纳米载药体系,DCs来源的外泌体还具有天然的免疫激活功能。基于此,该研究团队选择MUC1(Tn)作为肿瘤抗原靶标,设计使用DCs来源外泌体作为抗肿瘤疫苗的佐剂和载药工具,并通过生物正交反应将经过N3基团修饰的MUC1(Tn)抗原经DBCO-NHS辅助加载到DCs来源的外泌体上,首次制备出一种MUC1-Dex共价偶联的新型有效的抗肿瘤疫苗。该新型偶联疫苗不仅可以促进DCs的成熟及多种免疫共刺激分子的表达,还成功刺激免疫小鼠产生较强的MUC1特异性IgG抗体,诱导机体产生了有效的CTL反应。并最终在预防性和治疗性荷瘤小鼠模型中成功抑制了肿瘤的生长速度,延长了荷瘤小鼠的生存期。综上所示,DCs来源的外泌体是一种很有前途的疫苗载体,同时可起到增强癌症疫苗免疫刺激作用,具有成为有效佐剂的潜力。以上结论不仅为抗肿瘤疫苗的设计提供了新思路,还为其临床转化奠定了基础。