HER2阳性肿瘤(如乳腺癌、胃癌)是临床上恶性程度高、易转移的肿瘤类型。尽管PD-1/PD-L1免疫疗法联合曲妥珠单抗取得了一定疗效,但响应率仍较低。一个重要的原因是肿瘤微环境中大量浸润的Tregs抑制了效应T细胞的抗肿瘤功能。CCR4+ Tregs通过趋化作用浸润HER2+肿瘤微环境,促进肿瘤免疫逃逸。现有CCR4靶向疗法(如莫格利珠单抗)在清除全身性Tregs时易引起显著毒性,且目前仅用于血液肿瘤。此外,肿瘤趋化性外周Tregs作为肿瘤浸润Tregs的关键前体细胞,在以往的治疗策略中常被忽视。
药学院郗日沫教授团队设计了四种不同的CCR4靶向域掩蔽程度的抗HER2×CCR4 DVD-Ig双特异性抗体,在保留抗HER2域完全暴露的同时,实现了针对肿瘤相关Tregs(包括肿瘤浸润性与外周趋化性Tregs)的特异性清除。通过体外稳定性与抗肿瘤活性评估,优选出具有最佳抗CCR4域暴露的候选分子XL-11,并在人源免疫系统重建的NOG小鼠肿瘤模型中系统评价其药效、安全性、免疫记忆、与PD-1/L1阻断剂的协同效应及药代动力学特性。研究成果以" Anti-HER2×CCR4 bispecific antibody enhances antitumor immunity in advanced HER2-positive tumors by chemotaxis blockade and depletion of tumor associated Tregs, without inducing systemic toxicity"为题,发表于《Journal for ImmunoTherapy of Cancer》。
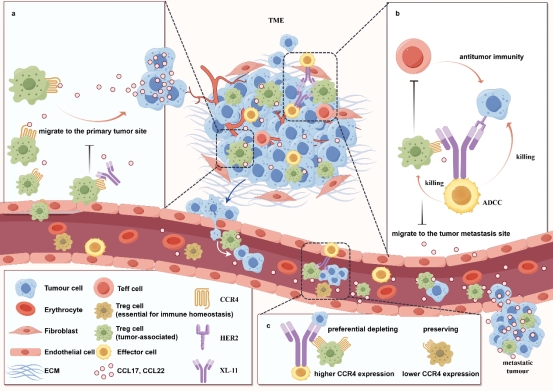
团队采用DVD-Ig技术平台,构建了四种四价双特异性抗体候选分子,其核心创新在于外层高亲和力抗HER2结构域与内层适度亲和力抗CCR4结构域的梯度设计。这种“外强内弱”的结构使XL-11优先靶向HER2阳性的肿瘤微环境中的Treg细胞,而在外周循环中保持"沉默",避免系统性Treg耗竭引起的副作用。
XL-11在有效抑制CCL22介导的Tregs向肿瘤和转移灶迁移的同时,还能通过ADCC效应杀伤HER2阳性肿瘤细胞和CCR4阳性的肿瘤相关Treg细胞。显著提升了肿瘤内CD8+ T细胞/Treg细胞的比例,解除了免疫抑制,恢复了效应T细胞的功能。值得注意的是,XL-11与PD-1抑制剂联用能产生协同效应,为临床联合治疗提供了理论依据。XL-11还表现出良好的稳定性和药代动力学特征,支持其临床转化潜力。
郗日沫团队提出了一种针对晚期 HER2+ 恶性肿瘤的有前景的策略。这项工作推进了Treg细胞靶向疗法的发展,拓展了莫格利珠单抗的应用范围,并增强了抗 PD-1 抗体对肿瘤的作用效果。
南开大学为该项工作的第一完成单位,药学院2023级博士生王超坤为该论文的第一作者,郗日沫教授为本文的通讯作者。
论文原文链接:https://jitc.bmj.com/content/13/12/e012829