光疗利用光敏剂将光能转化为活性氧或热量来局部杀死肿瘤细胞。同时,光疗还可诱导肿瘤发生免疫原性细胞死亡(ICD),释放损伤相关分子模式(DAMPs)随后触发免疫识别,激活抗原呈递细胞(APCs),最终引发抗肿瘤免疫反应。然而,常见的程序性细胞死亡类型,即凋亡和坏死,ICD诱导效应较弱。凋亡,甚至具有一定抗炎性质,从而导致免疫耐受。
研究人员发现,细胞焦亡(pyroptosis)是一种高度炎症性的新型程序性细胞死亡方式。最初研究发现,经caspase-1切割gasdermin-D(GSDMD)可在多种癌细胞中诱导焦亡。2017年,邵峰院士团队证实,由caspase-3介导的细胞凋亡可通过切割gasdermin-E(GSDME)转变为细胞焦亡。随后,基于以上通路的多个细胞焦亡光敏剂相继报道。这些光敏剂大多属于II型光动力疗法(PDT)分子,其产生细胞毒性的单线态氧(1O2)高度依赖于氧气(O2),对于普遍缺氧的实体瘤微环境,其进一步应用面临挑战。
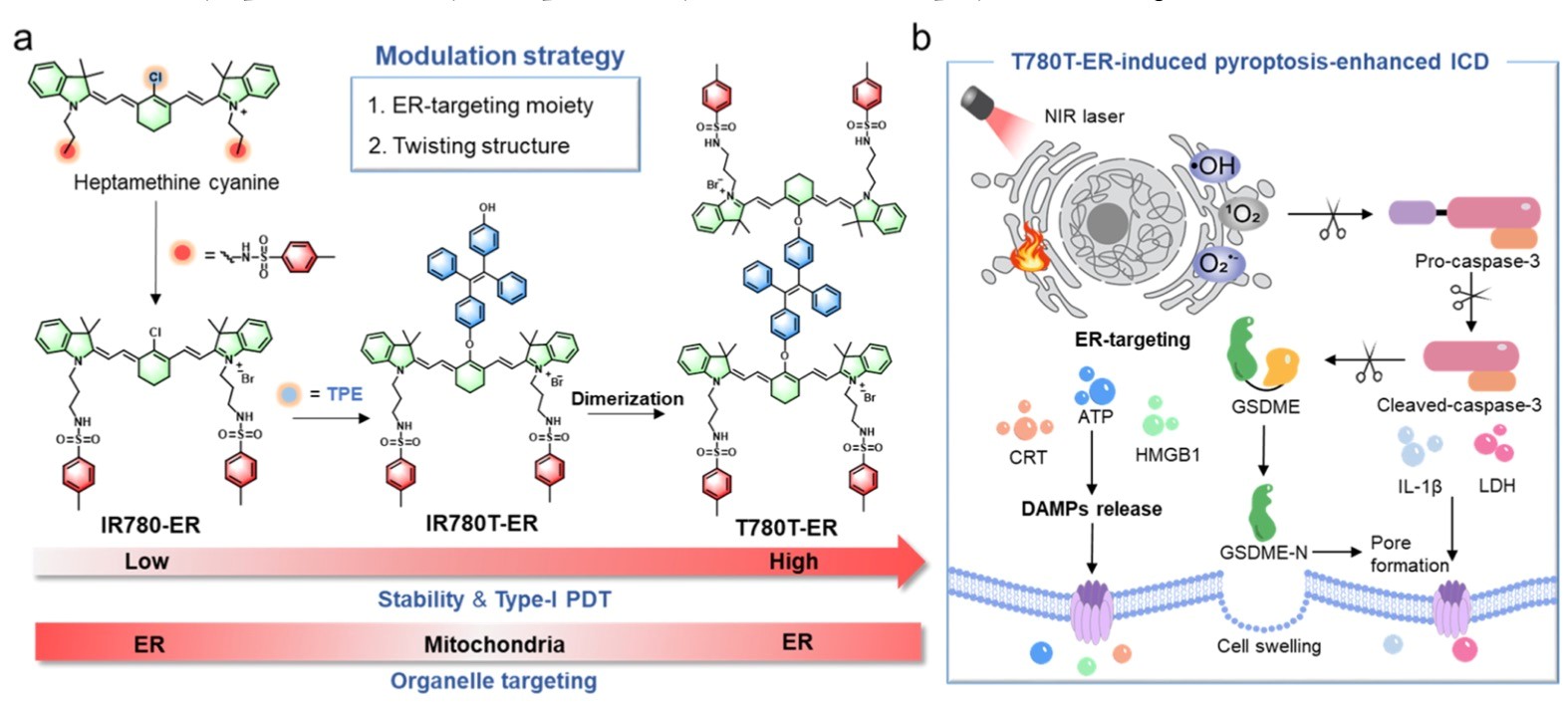
另一方面,光敏剂诱导的焦亡也被证实与其细胞定位密切相关。目前报道的细胞焦亡光敏诱导剂多定位于细胞膜、内质网、线粒体和溶酶体,其中靶向内质网(ER)和线粒体的光动分子在诱导细胞焦亡方面最具优势。然而,靶向内质网的焦亡光敏剂很少,激发波长660 nm以上的近红外分子报道更少。
2025年5月,南开大学药学院郗日沫教授和孟萌教授、天津大学赵秀杰副研究员在Analytical Chemistry杂志发表了题为“Dual-Modulation Design to Develop ER-Targeting NIR Pyroptosis Inducers with Type I PDT Efficacy and Amplified Antitumor Immunity”的研究性论文。该研究通过双调控设计开发内质网靶向近红外焦亡诱导剂,发挥I型光动力的抗肿瘤治疗作用。

该研究通过引入内质网靶向单元和增强分子内扭转性能的双调控策略,基于七甲基花菁分子的单体和二聚体进行性能验证,得到最优花菁染料(T780T-ER)。作为一种具有扭曲结构的二聚体,T780T-ER展现出优异的光热稳定性和高效的I型活性氧(ROS)生成能力。在体外PDT/PTT作用下,T780T-ER可上调GRP78以诱导内质网应激(ER stress),进而触发ICD效应。经证实,T780T-ER通过caspase-3/GSDME通路激活焦亡,并刺激炎性细胞因子和DAMPs的释放。在体内实验中,瘤内注射T780T-ER充分抑制了原发瘤的生长,并增强了针对原发瘤和远端瘤的抗肿瘤免疫效力,该效应即使低温光疗条件下也能够有效地抑制远端肿瘤的生长。该研究提出了一种内质网靶向光敏剂的双调控设计策略,并提供了一种具有I型光动力疗法的分子(T780T-ER),其通过内质网应激诱发细胞焦亡,能够引发强效ICD应答,从而抑制肿瘤生长。
南开大学为该项工作的第一完成单位,南开大学药学院2022级博士生马艳为该论文的第一作者。南开大学药学院郗日沫教授和孟萌教授、天津大学赵秀杰副研究员本文的共同通讯作者。该工作得到国家自然科学基金委项目和北京大学天然药物与仿生药物国家重点实验室开放课题的资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acs.analchem.5c01434?fig=tgr1&ref=pdf