(通讯员 马岚)南开大学药学院杨光副研究员联合东莞理工学院的王晓季教授课题组,于近日在药物化学领域顶级期刊Journal of Medicinal Chemistry(DOI:10.1021/acs.jmedchem.1c00996)上发表文章“Proteolysis Targeting Chimera (PROTAC) Modification of Dovitinib Enhances Antiproliferative Effect against FLT3-ITD Positive Acute Myeloid Leukemia Cells”,并被评为该杂志的封面文章。该研究团队针对第一代FLT3-ITD多靶点激酶抑制剂——多韦替尼(Dovitinib)选择性差,药物使用量大,药物体内蓄积,临床治疗效率较低等缺点,在此基础上通过PROTAC分子的设计原理,优化E3连接酶配体和linker的结构,筛选得到两种对FLT3-ITD突变白血病的治疗有潜力的药物分子。

急性髓系白血病(Acute myeloid leukemia, AML)是一种具有遗传多样性和侵袭性的血液恶性肿瘤,源于未成熟髓系祖细胞分化受阻和无序增殖。Fms相关酪氨酸激酶3(FLT3)是一种在造血细胞上表达的酪氨酸激酶受体。在约30%的急性髓系白血病(AML)病例中发现FLT3的激活突变。该突变导致FLT3构成性激活,从而激活多种细胞内信号分子,如PI3K/AKT、MAPK/ERK,进而促进白血病细胞增殖,抑制细胞凋亡。多项研究表明FLT3-ITD患者复发率高,临床预后差,总生存率低。因此,FLT3-ITD是治疗FLT3-ITD阳性AML的有效靶点。
在过去的十年中,许多药物被开发为有效的FLT3-ITD抑制剂,例如一代的Dovitinib,Sorafenib,Midostuin等,最近,一些相对更具选择性的第二代FLT3-ITD抑制剂,例如Crenolanib,Quizartinib,FF-10101等高选择性的FLT3-ITD分子也在经历不同阶段的临床试验中。然而,大多数患者最初得到缓解,很快出现耐药性和其他的安全问题。为了满足日益增长的AML病人的临床需求,研发更加安全高效的药物分子依然迫在眉睫。除了直接抑制FLT3的激酶活性外,诱导FLT3- ITD降解正成为一种新策略。蛋白质水解靶向嵌合体(PROTACs)技术提供了一个理想的方法。

PROTACs设计原理
本研究初步筛选得到两种化合物(1和2)具有显著的抗MOLM-13和MV-4-11细胞(FLT3-ITD+ AML细胞)增殖作用。进一步的生物学评价表明,用药物处理以后,细胞内形成蛋白、PROTAC分子和E3连接酶三元复合体,显著上调FLT3-ITD蛋白的泛素化水平并诱导FLT3-ITD蛋白以泛素-蛋白酶体依赖的方式发生高效的降解,并在低纳摩尔浓度下即可完全阻断其下游信号通路并诱导细胞凋亡。

化合物1和2通过泛素-蛋白酶体系统诱导FLT3-ITD蛋白降解
值得一提的是,在小鼠体内肿瘤异种移植评价模型中,我们通过尾静脉注射MV-4-11细胞到全免疫缺陷的小鼠,然后静脉给药化合物1和2(3 mg/Kg),结果显示,化合物1和2显著下调了白血病小鼠中CD45+细胞的数量,药物安全性较好,表明化合物1和2是一种对FLT3-ITD突变白血病的治疗有潜力的药物分子。
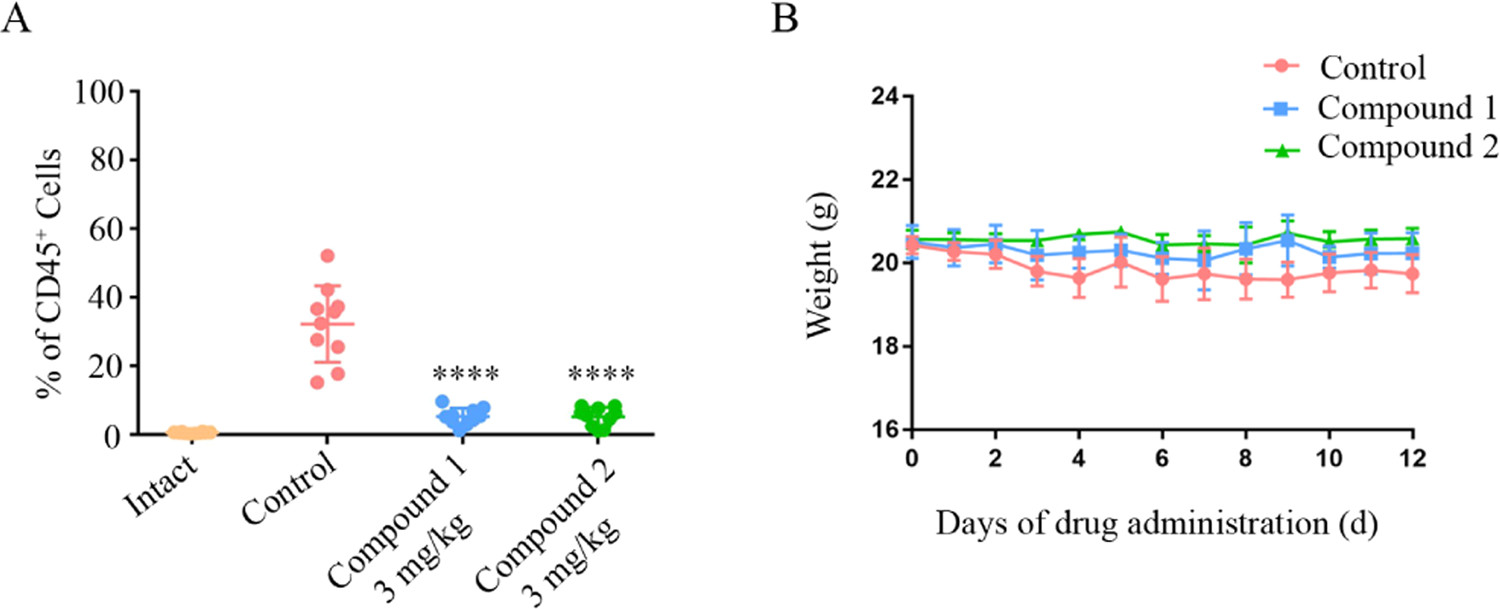
化合物1和2在体内模型中的抗白血病作用
南开大学药学院博士生曹胜、硕士生马岚、博士生刘煜琳和博士后魏明明博士为该论文共同第一作者。东莞理工学院的王晓季教授,南开大学药学院杨光副研究员为该论文共同通讯作者。南开大学为第一完成单位。
该项工作得到了国家自然科学基金,天津市科技重点支撑项目等基金的支持。
全文链接:http://pubs.acs.org/doi/10.1021/acs.jmedchem.1c00996