
论文截图
南开新闻网讯(通讯员 付丹 记者 吴军辉)记者获悉,南开大学郭宇、张宏恺、饶子和联合研究团队与和铂医药共同研发的新冠病毒中和性抗体初步完成临床前研究。他们通过高分辨率X射线晶体学结构揭示了3种新型结合表位的中和抗体。其中,抗体PR1077在动物模型中表现出良好的抗病毒效果。这一研究结果将为开发针对COVID-19的单克隆抗体相关治疗性干预措施提供重要信息。
5月7日,介绍该工作的论文“Structural basis for SARS-CoV-2 neutralizing antibodies with novel binding epitopes”在线发表于国际知名学术期刊PLOS Biology上。
由新型冠状病毒(SARS-CoV-2)引起的严重急性呼吸系统综合症(COVID-19)的大流行前所未有地威胁着全球公共卫生安全。针对新冠病毒的中和抗体已被证明是预防和治疗干预的有效措施。但是,目前对于新冠病毒的更多关键表位和免疫原性特征的认知仍较为有限。这在一定程度上阻碍了新一代抗体疗法的发展。此外,目前大多数已报道的中和抗体都源自于若干种常见优势抗体谱系,并通过识别相似的表位发挥中和活性,全新结合表位中和抗体分子的相关研究将为新一代重组疫苗的设计提供重要的支持信息。
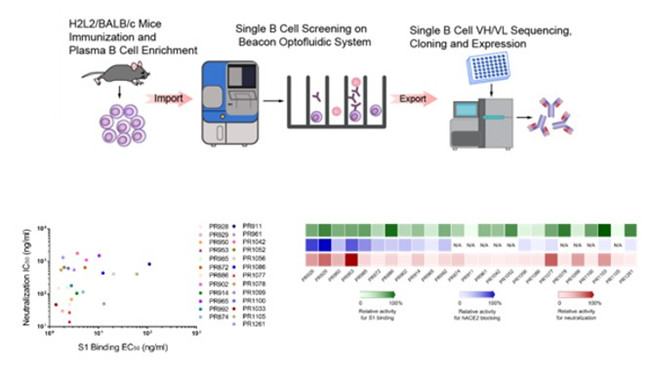
图1. 通过新型抗体发现平台进行H2L2/BALB/c小鼠免疫及抗体分离
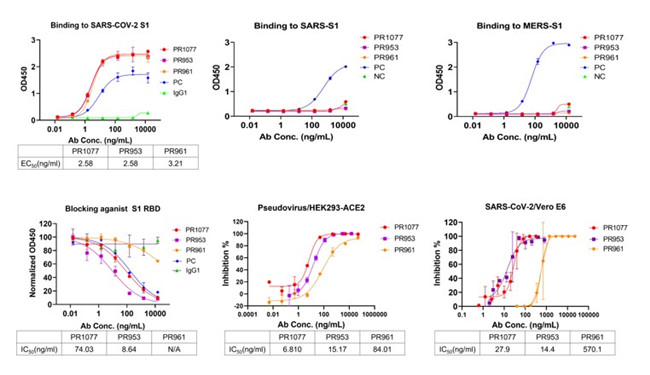
图2. PR1077、PR953、PR961三种中和性抗体的活性测试结果
研究团队应用H2L2全人源抗体发现平台,发现了一株全人源中和抗体(PR1077),以及两株人源化中和抗体(PR953和PR961),三种抗体均在sub-nM水平上显示出强大的中和活性。研究团队进一步通过高分辨率X射线晶体结构揭示了PR1077和PR953的受体结合基序上的新颖表位,两者均直接与hACE2竞争结合,同时在受体结合基序(RBM)区附近的相邻位点上也发现了PR961新的非阻断表位。其中,PR1077重链和轻链的包埋表面积(BSA)分别为873.5Å2和190.8Å2,与新冠病毒受体结合结构域(RBD)的相互作用主要由极性相互作用和氢键介导,通过空间位阻效应阻碍了新冠病毒受体结合结构域与受体hACE2的结合;PR953的互补决定区(CDR)形成了一个深凹的结合袋,并紧密覆盖了RBM区的柔性尖端,与hACE2的结合位点部分重叠,其与新冠病毒受体结合结构域相互作用主要由广泛的氢键网络构成,通过静电相互作用进一步稳定;PR961则在PR953的另一侧识别新冠病毒受体结合结构域,该表位与RBM区相邻,虽不产生对hACE2受体结合的直接位阻,但仍然表现出极强的中和效果。

图3. PR1077、PR953、PR961三种中和性抗体与SARS-CoV-2 RBD的复合物结构
在此基础上,研究团队与中国科学院武汉病毒所胡志红、王曼丽团队合作,进一步在Ad5-hACE2转导的COVID-19小鼠模型中测试了PR1077的抗病毒效果,预防组和治疗组的测试结果均显示单次注射可有效抵抗新冠病毒感染。
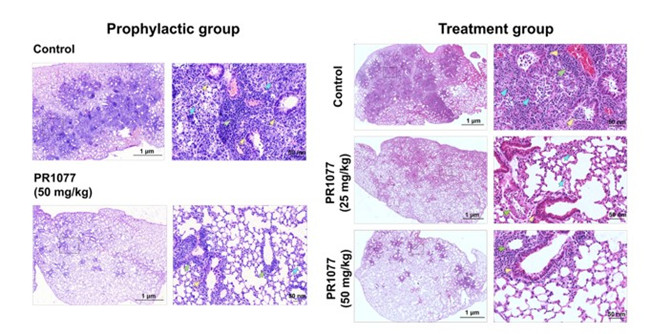
图4. PR1077在SARS-CoV2感染的AdV-hACE2转导小鼠中的治疗效果
南开大学博士生付丹、张光顺、王雨徽,硕士生张争,铂医药邬俊博士等为该论文共同第一作者。南开大学郭宇教授、饶子和院士、张宏恺教授、和铂医药刘礼乐等为论文的共同通讯作者。南开大学为论文第一单位。
该研究工作得到了中国科学院武汉病毒研究所、广州实验室、上海同步辐射光源等单位的大力支持,以及国家重点研发计划、国家自然科学基金、天津市自然科学基金重点项目、广州实验室新冠应急攻关项目、南开大学基础科研业务费等项目经费支持。
论文链接:
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3001209